压强对化学平衡的影响_压强对化学平衡的影响
压强对化学平衡的影响_压强对化学平衡的影响

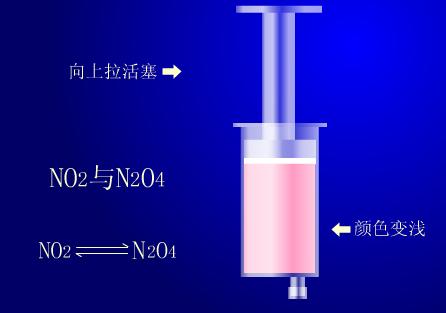


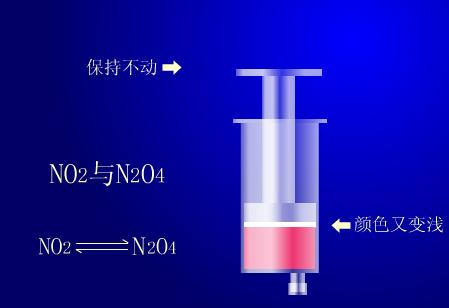
实验演示
操作方法
用一支注射器(50mL或更大些的)吸入约30mL二氧化氮和四氧化氮的混合气体,并将针头插入胶塞封闭。然后推针管将二氧化氮急速压缩,观察针管内气体的颜色变化。再拉针管使二氧化氮气体急速膨胀,观察管内气体的颜色变化。
[NextPage]
实验现象
当推针管急速压缩气体时,可以看到针管内气体颜色先变深后慢慢变浅。当拉针管急速膨胀气体时,针管内气体颜色先变浅后慢慢变深。
实验结论
管内气体存在平衡,推针管气体颜色先深后浅,是因为管内气体体积减小,浓度增大而变深,后变浅是因压强增大使平衡向生成物方向移动。四氧化二氮为无色气体,所以混合气体颜色变浅。拉针管时气体颜色先浅后深,是因为拉针管,管内气体体积膨胀,压强减小,浓度降低,后变深是因为压强减小,使上述平衡左移,生成较多红棕色气体。综合上述实验可知,在其他条件不变的情况下,增大压强,会使化学平衡向着气体体积缩小的方向移动;减小压强,会使平衡向着气体体积增大的方向移动。
实验考点
1、压强影响平衡的实质;2、浓度和压强对平衡影响的异同。
经典考题
1、在一密闭容器中,反应aA(g)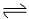 bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A、平衡向正反应方向移动了 B、物质A的转化率减少了
C、物质B的质量分数增加了 D、a>b
试题难度:易
2、体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同条件下发生反应:
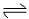
 并达到平衡,在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2转化率为p%,则乙容器中SO2转化率为( )
并达到平衡,在这个过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2转化率为p%,则乙容器中SO2转化率为( )
A、等于p% B、大于p% C、小于p% D、无法判断
试题难度:中
3、反应NH4HS(s)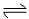 NH3(g)+H2S(g),在某一温度下达到平衡.下列各种情况,不能使平衡发生移动的是( )
NH3(g)+H2S(g),在某一温度下达到平衡.下列各种情况,不能使平衡发生移动的是( )
A、某他条件不变时,通入SO2气体
B、移走一部分NH4HS固体
C、容器体积不变,充入N2
D、压强不变时,充入N2
试题难度:难
1 答案:AC
2 答案:B
解析:该反应是一个正向气体的物质的量减小的反应,乙容器保持压强不变,体积会减小,平衡时压强比甲中大,相对于甲容器,乙中平衡右移,转化率增大。
3 答案:BC
解析:固体的多少不影响化学反应速率,不会使平衡移动,B错。C中,充入氮气,虽然总压增大,但是参与反应的各种气体产生的分压没有发生变化,化学反应速率不变,平衡不移动。
化学平衡常数
是指在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始,也不管反应物起始浓度大小,最后都达到平衡,这时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值是个常数,用K表示,这个常数叫化学平衡常数
(1)平衡常数表达式及其意义
对于化学反应 mA+nB pC+qD
在一定温度下达到化学平衡时,其平衡常数表达式为:
K=[cp(C)·cq(D)]/[cm(A)·cn(B)]
在书写平衡常数表达式时,要注意以下问题:
① 在应用平衡常数表达式时,稀溶液中的水分子浓度可不写。因为稀溶液的密度接近于1 g/mL。水的物质的量浓度为55.6 mol/L。在化学变化过程中,水量的改变对水的浓度变化影响极小,所以水的浓度是一个常数,此常数可归并到平衡常数中去。
对于非水溶液中的反应,溶剂的浓度同样是常数。
② 当反应中有固体物质参加时,分子间的碰撞只能在固体表面进行,固体的物质的量浓度对反应速率和平衡没有影响,因此,固体的“浓度”作为常数,在平衡常数表达式中,就不写固体的浓度。
③ 化学平衡常数表达式与化学方程式的书写方式有关。同一个化学反应,由于书写的方式不同,各反应物、生成物的化学计量数不同,平衡常数就不同。但是这些平衡常数可以相互换算。
④ 不同的化学平衡体系,其平衡常数不一样。平衡常数大,说明生成物的平衡浓度较大,反应物的平衡浓度相对较小,即表明反应进行得较完全。因此,平衡常数的大小可以表示反应进行的程度。
(2)平衡常数的测定
平衡常数可以用实验方法测定,也可以利用热力学数据计算而得。
实验方法通常有化学方法和物理方法。
化学方法是通过化学分析法测定反应达到平衡时各物质的浓度。但必须防止因测定过程中加入化学试剂而干扰了化学平衡。因此,在进行化学分析之前必须使化学平衡“冻结”在原来平衡的状态。通常采用的方法是采取骤冷、稀释或加入阻化剂使反应停止,然后进行分析。例如,要测定反应2H2+O2 2H2O在2 000 ℃达到平衡时的平衡常数,可以将一定量的水置于耐高温的合金管中加热,在2 000 ℃时保持一段时间,使之达到化学平衡。然后,将管子骤然冷却,再分析其中H2O、H2、O2的含量,便可计算出在2 000 ℃时这个反应的平衡常数。
物理方法就是利用物质的物理性质的变化测定达到平衡时各物质浓度的变化,如通过测定体系的折光率、电导、颜色、压强或容积的改变来测定物质的浓度。物理方法的优点是在测定时不会干扰或破坏体系的平衡状态。
(3)平衡常数的单位
平衡常数有标准平衡常数和非标准平衡常数之分,前者的量纲为一,后者的量纲取决于平衡常数的表达式。
根据标准热力学函数算得的平衡常数是标准平衡常数,记作K,又称之为热力学平衡常数;用平衡时生成物对反应物的压力熵或浓度熵表示的平衡常数是经验平衡常数(Kp或Kc),或称作非标准平衡常数。中学教材中涉及的平衡常数是经验平衡常数。
大家知道,一些重要的热力学函数,如U、H、F、G等的绝对值是无法确定的。为了计算它们的相对大小,需要统一规定一个状态作为比较的标准,这样才不致引起混乱。所谓标准状态是指在温度T和标准压力 (101·325KPa)下物质的特定状态,简称标准态。热力学数据表中的标准态,国际上都已有明确规定。
对于反应物计量系数之和等于生成物计量系数之和的反应,其经验平衡常数是无量纲的纯数,与压力、浓度所用的单位无关,而且也等于标准平衡常数之值。
对于反应物计量系数之和不等于生成物计量系数之和的反应,则其经验平衡常数是有量纲的量,其数值就与压力、浓度所用的单位有关。也只有当压力、浓度的单位与热力学数据表中对应标准态的单位相同时,所计算的经验平衡常数数值才能与标准平衡常数数值相同。
https://m.oubohk.cn/huaxue/60339/





