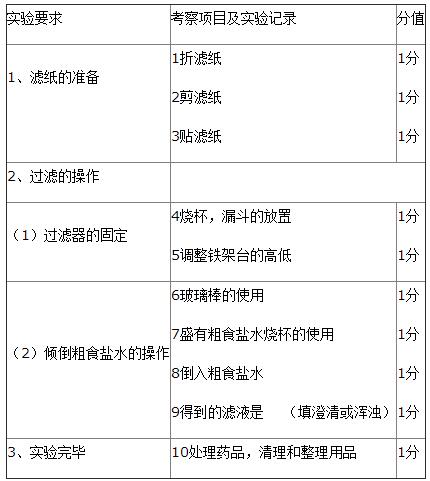
[生成热 反应热 燃烧热]反应热、中和热、燃烧热的联系与区别
[生成热 反应热 燃烧热]反应热、中和热、燃烧热的联系与区别
反应热是近几年高考的重点内容之一,题型一般为选择和填空,考查的内容主要有:热化学方程式的正误判断、比较反应热的大小、有关反应热的计算等。
不能根据反应条件是否需要加热来判断一个反应是放热反应还是吸热反应,因为有些放热反应需要加热才能进行,而有些吸热反应在常温下也可自发进行。
实际上反应热就是反应物分子中旧的化学键断裂时所吸收的总能量与形成的生成物分子中新的化学键所释放的总能量之差。△H=∑E(反应物键能)-∑E(生成物键能)。同样当“△H”为“-”即△H<0时为放热反应;反之,为吸热反应,这时“△H”为“+”即△H>0。
【例题1】(09重庆高考)下列热化学方程式书写正确的是(△H的绝对值均正确)
A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)== NaCl(aq)+H2O(l);△H=+57.3 kJ/mol(中和热)
C.S(s)+O2(g)=== SO2(g);△H=-269.8 kJ/mol(反应热)
D.2NO2 == O2+2NO;△H=+116.2 kJ/mol(反应热)
解析:A项燃烧热要求可燃物的物质的量必须为1mol,得到的氧化物必须是稳定的氧化物,即H2O的状态必须为液态,因此A选项错误;中和反应是放热反应,△H应小于0,因此B选项错误;热化学反应方程式要注明物质在反应时的状态,因此D选项错误。只有C选项正确。
答案:C
【例题2】(09四川高考)25℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ·mol-1。下列热化学方程式书写正确的是
A.2H+(aq) +SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(1);△H=-57.3 kJ·mol-1
B.KOH(aq)+ H2SO4(aq) = K2SO4(aq)+H2O(l);△H=-57.3 kJ·mol-1
C.C8H18(l)+ O2 (g) = 8CO2 (g)+ 9H2O(g);△H=-5518 kJ·mol-1
D.2C8H18(g)+25O2 (g) =16CO2 (g)+18H2O(1);△H=-5518 kJ·mol-1
解析:中和热的标准是生成1 mol H2O(l)时所放出的热量,A项不符合中和热的定义;燃烧热要求必须生成稳定的氧化物,C项中生成物水为气态,应该为液态。D项中辛烷的物质的量不是1 mol,D中△H=-11036 kJ·mol-1才正确。所以ACD错误。
答案:B
点拨:燃烧热、中和热概念的理解及热化学方程式的正确书写是解该题的关键。
【例题3】(08年海南高考)白磷与氧可发生如下反应:P4 + 5O2 === P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P a kJ·mol-1、P-O b kJ·mol-1、
P=O c kJ·mol-1、O=O d kJ·mol-1。
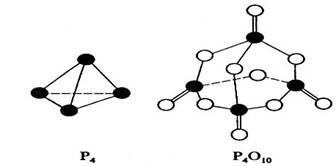
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是
A.(6a + 5d-4c-12b)kJ·mol-1 B.(4c + 12b-6a-5d)kJ·mol-1
C.(4c + 12b-4a-5d)kJ·mol-1 D.(4a + 5d-4c-12b)kJ·mol-1
解析:由图可以看出1 mol P4 中有6 mol P-P键,5 mol O2 中有5 mol O=O键,1 mol P4O10中有4 mol P=O键、12 mol P-O键,所以△H =(6a + 5d-4c-12b)kJ·mol-1。
答案:A
点拨:化学反应的实质就是旧化学键的断裂和新化学键的形成,在断裂和形成的过程中伴随着能量的吸收和释放。
来源:人民教育出版社
[生成热 反应热 燃烧热]反应热、中和热、燃烧热的联系与区别
https://m.oubohk.cn/huaxue/239993/