铜与浓硝酸反应的化学方程式铜与浓硝酸反应
【铜与浓硝酸反应的化学方程式】铜与浓硝酸反应


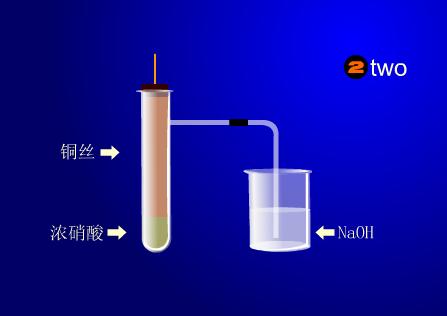
实验演示
操作方法
取一支洁净的试管,向试管中加入约0.5毫升的浓硝酸,将一底端弯成螺旋状的铜丝插入浓硝酸中,观察现象。 过一会儿将试管中的铜丝取出,向这个试管中加入约5毫升水,观察溶液颜色。
实验现象
将铜丝插入浓硝酸中,铜与浓硝酸发生剧烈反应。有红棕色气体产生,溶液呈绿色,当向这个试管加入5毫升水时溶液呈蓝色。
实验结论
铜与浓硝酸发生剧烈反应,有NO2气体放出,生成Cu(NO3)2。当加入水量不同时溶液的水合离子不同而使溶液呈不同颜色,反应方程式:Cu + 4HNO3(浓)=Cu(NO3)2 + 2NO2 ↑+ 2H2O
实验考点
1、金属与浓硝酸反应规律;2、金属活动性顺序表中H后面的金属与氧化性酸的反应特点与计算。
经典考题
1、浓硝酸和铜反应中如有0.5 mol电子发生转移,则被氧化的铜的质量为
A、64g B、32g C、16g D、6.4g
试题难度:易
2、向1L0.5mol/L的H2SO4溶液中加入10.1gKNO3和12.8gCu充分反应后产生的气体在标态下的体积为( )
A、2.24L B、3.36L C、4.48L D、5.60L
试题难度:中
3、为了测定某铜银合金的成分,将30.0g合金放入80mL 13.5mol/L的浓硝酸中,待合金完全溶解后,收集到气体6.72L(标准状况下),并测得溶液中C(H+)=1mol/L.假定反应后溶液的体积没有变化。试计算:
(1)被还原的硝酸的物质的量。
(2)合金中银的质量分数。
试题难度:难
1 答案:C
解析:铜在反应中,每摩尔铜失电子2摩尔,所以转移0.5摩尔电子,铜的物质的量是0.25摩尔。
2 答案:A
解析:根据离子反应方程式进行过量判断,然后利用最少量进行计算。
3 答案:(1) 0.3mol (2) 36%
解析:硝酸的还原产物是NO或NO2,和计算结果没有关系,1摩尔硝酸被还原一定得到1摩尔的还原气体,所以气体的物质的量就是被还原的硝酸的物质的量。然后根据氮原子守恒,硝酸分为三个部分:剩余的、体现酸性的和体现氧化性的。具体做法,可以设铜银的物质的量分别为X、Y,64X+108Y=30 根据硝酸根 2X+Y = 0.080L·13.5mol/L-0.3-0.08
王水及其氧化作用
王水是由1体积的浓硝酸和3体积的浓盐酸混合而成的(严格地说是在其混酸中HNO3和HCl的物质的量之比为1∶3)。王水的氧化能力极强,称之为酸中之王。一些不溶于硝酸的金属,如金、铂等都可以被王水溶解。尽管在配制王水时取用了两种浓酸,然而在其混合酸中,硝酸的浓度显然仅为原浓度的1/4(即已成为稀硝酸)。但为什么王水的氧化能力却比浓硝酸要强得多呢?这是因为在王水中存在如下反应:
HNO3 + 3HCl = 2H2O + Cl2 + NOCl
因而在王水中含有硝酸、氯分子和氯化亚硝酰等一系列强氧化剂,同时还有高浓度的氯离子。
王水的氧化能力比硝酸强,金和铂等惰性金属不溶于单独的浓硝酸,而能溶解于王水,其原因主要是在王水中的氯化亚硝酰(NOCl)等具有比浓硝酸更强的氧化能力,可使金和铂等惰性金属失去电子而被氧化:
Au + Cl2 + NOCl = AuCl3 + NO↑
3Pt + 4Cl2 + 4NOCl = 3PtCl4 + 4NO↑
同时高浓度的氯离子与其金属离子可形成稳定的络离子,如[AuCl4]- 或 [Pt Cl6]2-:
AuCl3 + HCl = H[AuCl4]
PtCl4 +2HCl = H2[Pt Cl6]
从而使金或铂的标准电极电位减小,有利于反应向金属溶解的方向进行。总反应的化学方程式可表示为:
Au + HNO3 + 4HCl = H[AuCl4] + NO↑+ 2H2O
3Pt + 4HNO3 + 18HCl = 3H2[Pt Cl6] + 4NO↑+ 8H2O
由于金和铂能溶解于王水中,人们的金铂首饰(黄金或白金)在被首饰加工商加工清洗时,常会在不知不觉中被加工商用这种方法偷取,损害消费者的利益。
王水和诺贝尔奖牌的轶事
有两位科学家,劳厄和弗兰克,曾获得1914年和1925年的物理学奖,德国纳粹政府要没收他们的诺贝尔奖牌,他们辗转来到丹麦,请求丹麦同行、1922年物理学奖得主玻尔帮忙保存。1940年,纳粹德国占领丹麦,受人之托的玻尔急得团团转。同在实验室工作的一位匈牙利化学家赫维西(1943年化学奖得主)帮他想了个好主意:将奖牌放入“王水”(盐酸与硝酸混合液)中,纯金奖牌便溶解了。玻尔于是将溶液瓶放在实验室架子上,来搜查的纳粹士兵果然没有发现这一秘密。战争结束后,溶液瓶里的黄金被还原后送到斯德哥尔摩,按当年的模子重新铸造,于1949年完璧归赵,当时弗兰克工作的美国芝加哥市还专门举行了一个隆重的奖牌归还仪式。
用王水“做手脚”洗项链盗黄金
2008年4月28日 内蒙古自治区鄂尔多斯市东胜区公安分局刑侦大队破获一起特殊的黄金盗窃案,犯罪嫌疑人是一名金银首饰加工店老板,这名吴姓老板利用给顾客清洗金项链之机盗窃黄金。盗窃行为败露后,这名盗金老板于4月18日被警方采取强制措施。
据介绍,4月1日下午,东胜区公安分局刑侦大队接到一市民报案称,自己的金项链在某金银首饰加工店进行清洗后,发现金项链不仅变瘦了,且项链上面的花纹也变得不清晰。他对金项链称重后发现,原来重达78克的金项链少了16.48克。
接警后,警方立刻赶到金银首饰加工店将店主带回讯问,同时将店内清洗金项链的药水拿回进行成分分析。经分析化验发现,原来店老板为了盗取黄金,专门用腐蚀性很强的“王水”清洗黄金项链。在证据面前,吴姓店老板交代,一般黄金等首饰清洗时,先用火烧,将黄金加热去除上面的油渍,然后将烧热的黄金放入盐酸溶液中清洗,这样上面的灰尘就被洗下来,而对黄金本身并没有损耗。但他为了谋利,将清洗溶液换成“王水”,利用化学反应窃取顾客的首饰黄金,浸泡时间越长窃取的黄金越多。
吴姓老板还交代,由于目前国家对首饰清洗没有统一标准和规定,所以一些小首饰加工店均以低价清洗为诱饵,等顾客光临后再用“王水”洗金子,这样的方法几乎成了业内公开的秘密,而且利润可观。针对这起特殊的黄金盗窃案,警方提醒清洗黄金首饰的人们,一定要到商业信誉好的大型正规金银首饰店进行委托加工或进行首饰清洗美容,切勿贪图便宜到一些管理较差的小店。
https://m.oubohk.cn/huaxue/58774/





